Science:施一公团队解析γ-分泌酶识别和连续切割淀粉样蛋白的分子机制
来源:生物世界 2024-12-12 10:49
这项研究使用冷冻电镜(cryo-EM)技术观察和描述了人类γ-分泌酶在APP切割过程中如何与不同的Aβ肽底物相互作用。
西湖大学施一公院士、清华大学生命科学学院周瑞等人在 Science 期刊发表了题为:Molecular mechanism of substrate recognition and cleavage by human γ-secretase 的研究论文。
该研究确定了人γ-分泌酶分别与APP-C99、Aβ49、Aβ46和Aβ43结合的原子分辨率的冷冻电镜(cryo-EM)结构,描述了人γ-分泌酶在淀粉样前体蛋白(APP)切割过程中如何与不同的Aβ肽底物相互作用,阐明了γ-分泌酶如何产生不同长度的Aβ肽,这些发现将加深我们对淀粉样蛋白生物学的理解,并有助于开发治疗阿尔茨海默病的策略。

成熟的γ-分泌酶由四个亚基组成,分别是前体蛋白酶(PS)、前体蛋白酶增强因子2(PEN-2)、前咽缺陷蛋白1(APH-1)和Nicastrin蛋白(NCT)。其中催化亚基是PS,而PS1是其主要的异构体。人γ-分泌酶与APP-C83结合的冷冻电镜(cryo-EM)结构揭示了底物和PS1之间的杂交β-折叠,底物β链引导切割位点,与APP-C83相比,由γ-分泌酶切割的APP-C99效率较低。APP-C99的N端多出的16个氨基酸可能调节γ-分泌酶-底物复合物的形成。
尽管已经在γ-分泌酶结构上取得了进展,但控制其连续切割的底层机制仍不清楚,特别是不清楚为什么切割过程中主要每次切割三个氨基酸残基。
在这项最新研究中,研究团队报告了人γ-分泌酶分别与其底物APP-C99、Aβ49、Aβ46和Aβ43结合的原子分辨率水平的冷冻电镜(cryo-EM)结构,这些结构分析揭示了其底物识别和切割的机制。该研究发现,在所有情况下,底物都具有相同的结构特征:一个跨膜α螺旋、一个由γ-分泌酶切割的三氨基酸残基连接肽和与PS1蛋白形成的杂合β折叠链。蛋白酶水解切割发生在底物β折叠链的前方。每个切割步骤之后,底物α螺旋会发生一次解旋和转位,并形成一个新的β折叠链。这种机制与现有的生化数据一致,可能可以解释γ-分泌酶切割其他底物的过程。
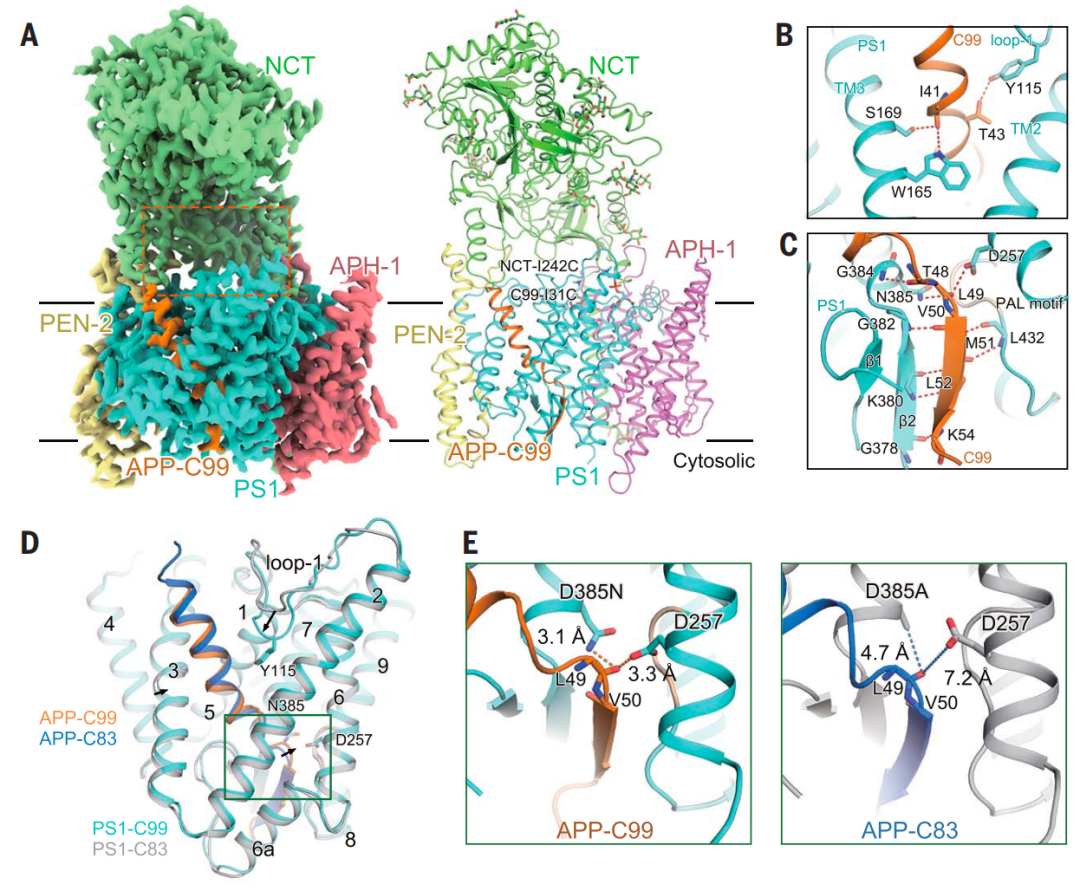
人γ-分泌酶识别APP-C99的结构基础
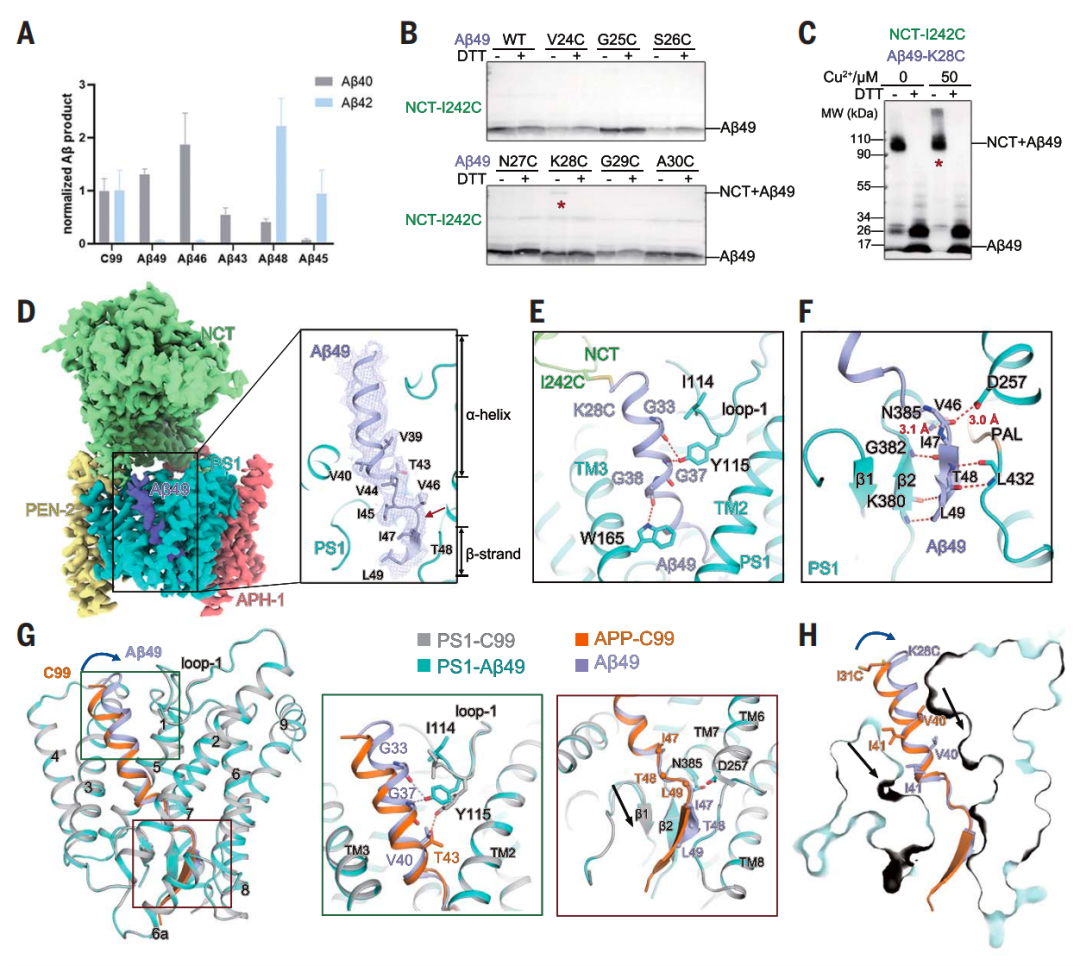
人γ-分泌酶对Aβ49的特异性识别
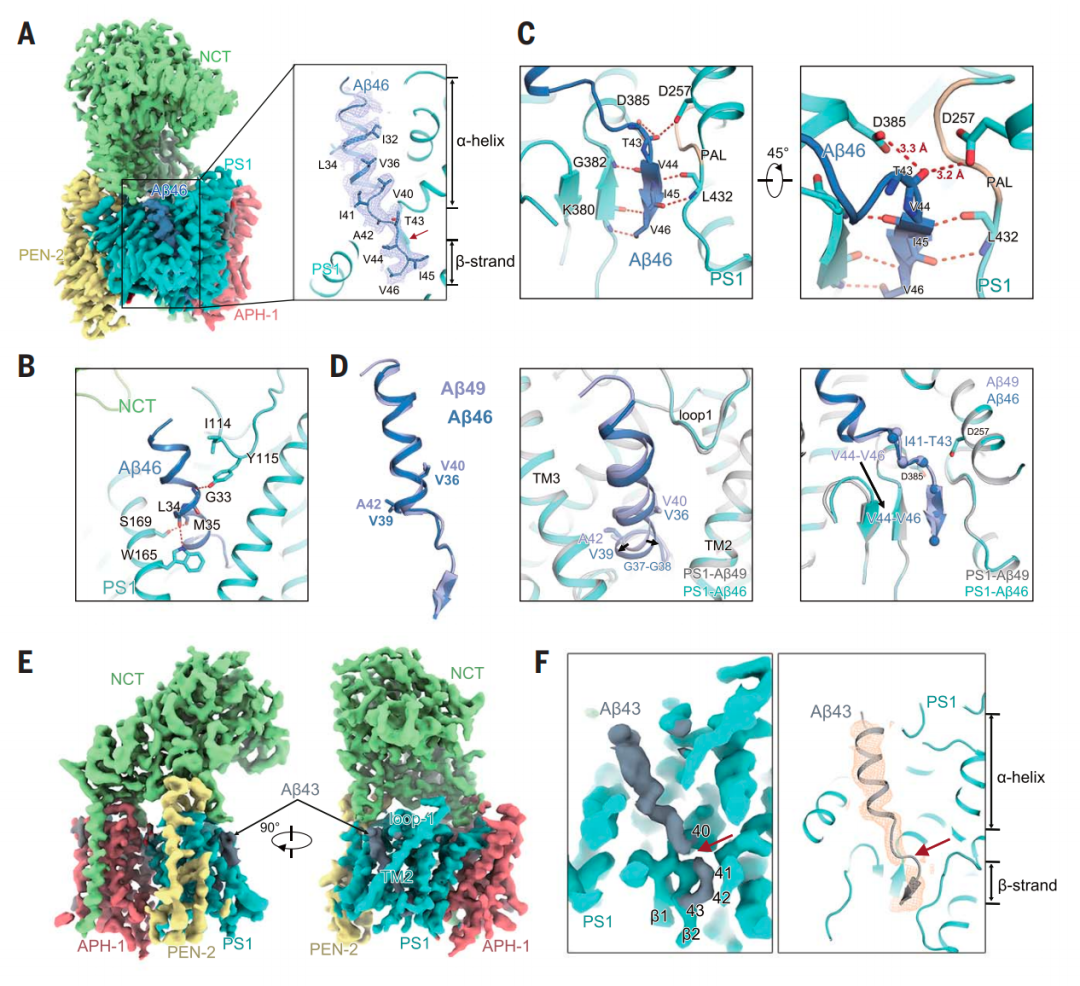
人γ-分泌酶对Aβ46和Aβ43的识别
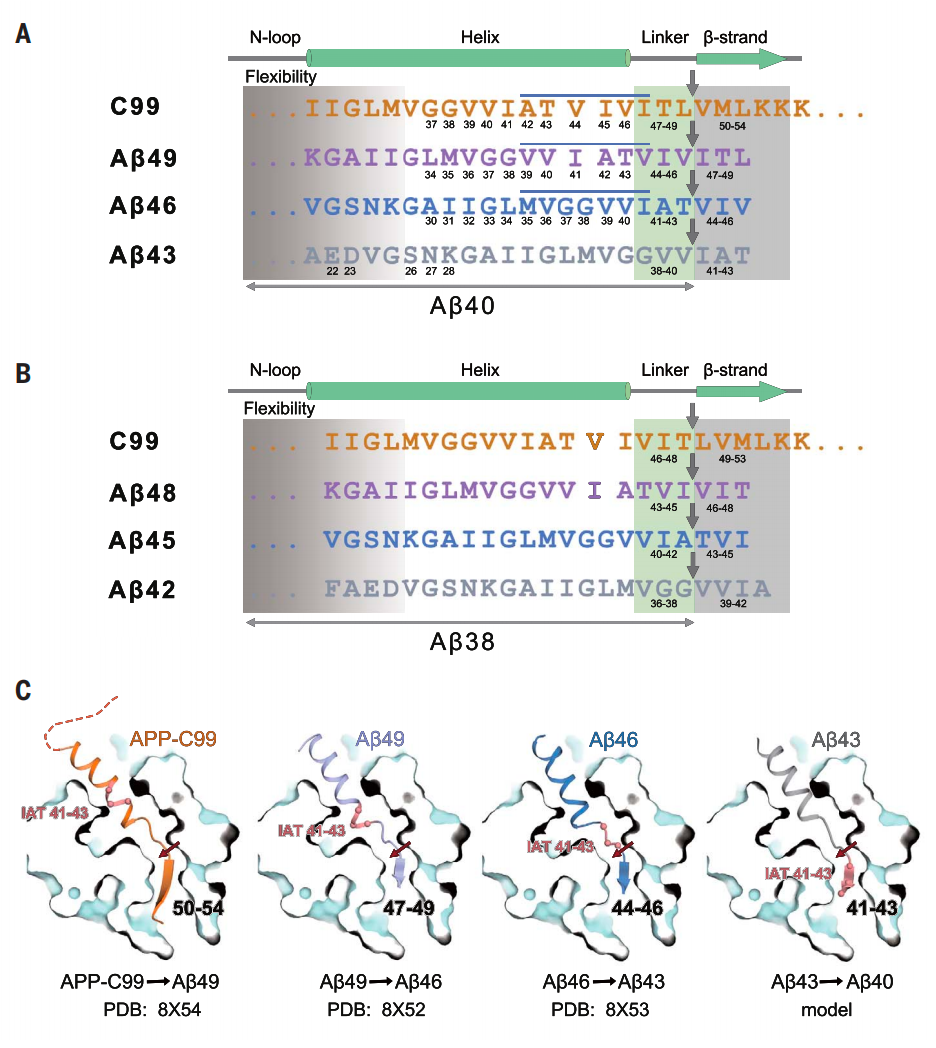
人γ-分泌酶裂解底物的机制
大脑神经元中β-淀粉样蛋白(Aβ)聚集是阿尔茨海默病(AD)等神经退行性病变的主要标志和原因之一。Aβ是由γ-分泌酶对淀粉样前体蛋白(APP)进行连续切割产生的,然而,这些多次切割的具体过程尚未完全阐明。
这项研究使用冷冻电镜(cryo-EM)技术观察和描述了人类γ-分泌酶在APP切割过程中如何与不同的Aβ肽底物相互作用。阐明γ-分泌酶如何产生不同长度的Aβ肽,将加深我们对淀粉样蛋白生物学的理解,并有助于开发治疗阿尔茨海默病的策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


